SPiDEM®
SPiDEM® Platform (Prazer’s approach to TPD)
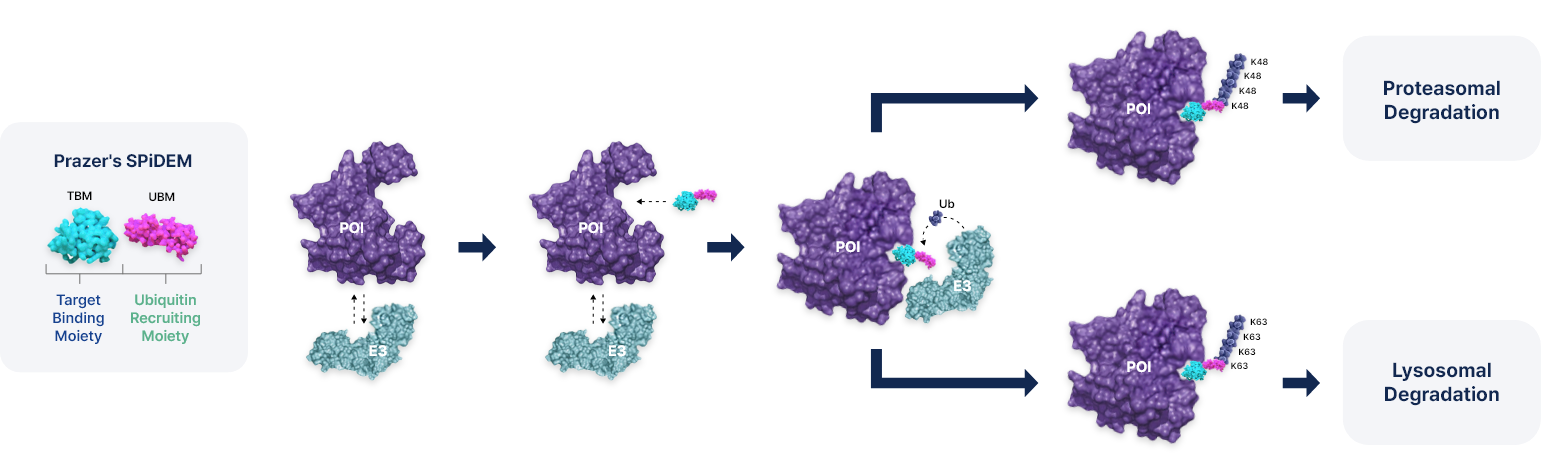
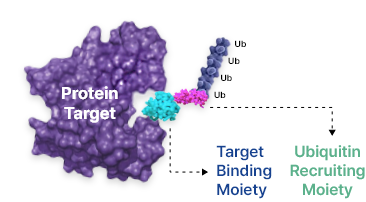
SPiDEM 기술은 질병을 유발하는 단백질을 특정 E3 ligase와 결합해 유비퀴틴화하는 기존 TPD 기술과 달리, 화합물 자체에 유비퀴틴화가 일어나는 혁신적인 기술임. 링커 부위가 없는 구조로 분자량이 작아 기존 PROTAC 기술의 한계를 극복할 수 있는 장점을 지님. 또한, 기존 TPD 기술이 특정 E3 ligase만을 활용하는 반면, SPiDEM 기술은 다양한 E3 ligase에서 유비퀴틴을 받아 표적 단백질의 특성에 따라 프로테아좀과 리소좀을 통해 표적단백질 분해가 가능함. 이러한 특성으로 기존 TPD 기술과는 다르게 핵 단백질, 세포질 단백질, 응집 단백질, 세포막 단백질 등 세포 내 모든 단백질을 표적화할 수 있음
Prazer Therapeutics’ goal is to identify and advance new mechanisms to tackle
the challenges faced by the previous generations of TPD therapeutics. Prazer’s proprietary TPD platform, selective protein degradation enabling moiety (SPiDEM), allows the rational design and rapid optimization of orally available and BBB-penetrating small molecules. SPiDEM’s novel degrading mechanism has potential for enhanced drug-likeness, expanded therapeutic applications, reduced risk of drug resistance and sustained efficacy.
-
1
Target binding moiety에 ubiqutin recruiting moity를 직접 연결하여 화합물이 직접 유비퀴틴화 되어 target protein을 분해하는 기술
-
2
Chemical ubiqutination 개념을 도입한 최초의 artificial chemical degron system
-
3
Proteasome/Lysosome system을 모두 사용하여 핵단백질, 세포질 단백질, 막단백질, 응집단백질 등 대부분의 표적단백질에 적용가능한 기술
Why Prazer’s SPiDEM Platform?
-
Versatile Platform with Enhanced Druglikeness
- Low molecular weights
- superior PK profiles
- BBB-penetrable
- Rational design and rapid optimization
- No need for intensive linker optiomization
-
Expanded Therapeutic Applications
- Harnessing broader set of E3 ubiquitin ligases
- Capable to induce both proteasomal and endocytosis /autophagy-mediated lysosomal degradation
- Suitable for membrane proteins and protein aggregates as well as soluble proteins
-
Reduced Risk of Drug Resistance
- Enhanced protein homeostasis
- More sustained efficacy
- Less subject to the hook effect